ETIOLOGÍA
La pediculosis palpebral es una causa poco común de blefaroconjuntivitis producida por piojos. Distinguimos dos tipos de piojos: mordedores y chupadores. Los piojos que afectan a humanos son ectoparásitos pertenecientes al filum de los artrópodos, clase insectos, orden anoplura y familia pediculidae de la que se conocen tres géneros: Phthirius pubis, pediculus capitis y pediculus corporis (1,2). P. pubis o ladilla es el más frecuentemente relacionado con la afectación palpebral. Son piojos chupadores, haustelados, con boca perforadora y succionadora, y de nutrición solenófaga ya que se alimentan directamente de los capilares (3). El piojo clava los dientes en la epidermis, introduce los estiletes del aparato perforador en la piel, deposita en la herida unas gotas de saliva y por medio de una bomba faríngea absorbe la sangre o jugos hísticos. Existen otros piojos que parasitan a otras especies animales.
P. pubis es fácilmente distinguible de los otros piojos por su tamaño y morfología (figs. 1-3) (4-6). Su tamaño,1-2 mm, es inferior a los 2-2,5 mm de p.capitis y 2-4 mm de p.corporis. Los machos suelen ser algo menores de tamaño. En cuanto a su morfología, p. pubis tiene un abdomen ancho y ovalado, a diferencia del abdomen más alargado y aplanado de los otros piojos. Sus tres pares de patas articuladas, con cinco segmentos cada una, acaban en una garra que les sirve para agarrarse a los pelos o a las fibras de la ropa. P. corporis y p. capitis tienen tres pares de patas similares, por el contrario, el segundo y tercer par de patas de p. pubis son más grandes y acabadas en una potente garra(7). Los piojos presentan dos antenas segmentadas provistas de termorreceptores (6).

Fig. 1. Ejemplar adulto de Phthirus pubis. Su abdomen es corto y ancho, y sus dos
pares de patas posteriores más anchas y acabadas en fuertes garras.

Fig. 2. Ejemplar adulto de pediculus capitis. Su abdomen es más alargado y
estrecho y sus patas son iguales.

Fig. 3. Diferencias morfológicas entre pediculus capitis y Phthirus pubis.
Los piojos son parásitos obligados del hombre. Dependen de su huésped para sobrevivir, y de él obtienen alimento y calor. Salvo p. corporis, tienen predilección por zonas con pelo. En la base del pelo depositan los huevos o liendres. Estos son traslúcidos, ovoides y operculados de unos 0,5 mm de tamaño, y quedan fuertemente adheridos gracias a una sustancia cementante de quitina que rodea al huevo y al pelo (figs. 4 y 5). Esta vaina es característica para cada piojo. La vaina de p. pubis es tan larga como el huevo, mientras que la de p. capitis es algo más corta (6). Los huevos se abren entre 10 y 14 días después de la puesta. Las ninfas o larvas son como los adultos, aunque de menor tamaño, y entre el 2.º y 4.º día comienzan a alimentarse y a mudar. El estadío de larva dura unos 10-15 días. El ejemplar adulto vive unos 30 días. Las hembras ponen distinto número de huevos según la especie y condiciones ambientales. P. corporis puede llegar a poner hasta 300 huevos, p. capitis unos 150 y p. pubis unos 30. El piojo se alimenta varias veces al día (7,8).

Fig. 4. Liendre de Phthirus pubis. Se adhiere fuertemente al pelo por una vaina
de quitina que rodea al huevo y al pelo.

Fig. 5. Liendres de Phthirus pubis. Vemos un parásito abandonando su huevo y otra
liendre ya vacía.
Los piojos son viajeros activos pasando fácilmente de un huésped a otro por contacto directo entre ellos o a través de sus ropas. P. capitis es más activo que p. pubis. Se mueve con agilidad disminuyendo su actividad en condiciones de temperaturas extremas y abandona a sus huéspedes cuando éstos tiene fiebre (7). Pueden llegar a sobrevivir fuera del huésped entre 24-48 horas (9,10). P. pubis es más sedentario en sus hábitos, desplazándose algo más en oscuridad (11). Se mantiene adherido por sus órganos bucales al mismo sitio durante varios días (7,12), siendo incapaz de vivir más de 12 horas fuera del huésped (13).
EPIDEMIOLOGÍA
Las infestaciones por piojos son ya relatadas en el antiguo Egipto (2). Se han encontrado liendres en momias halladas en el desierto de Judea con una antigüedad estimada de entre 8.300 y 9000 años, así como en cadáveres sepultados bajo la lava del Vesubio y en momias precolombinas (10,14,15). Hablamos de pediculosis cuando nos referimos a infestaciones por piojos, mientras que el término phthiriasis se emplea para parasitaciones por p. pubis. Desde los años 70, estamos asistiendo, en los países civilizados, a un aumento de las infestaciones por estos parásitos (9). Conocidas son las epidemias producidas por p. capitis en escolares, sobre todo en épocas de invierno. La tasa de infestación por p. capitis es de 14,8% (6). Afectan sobre todo a niños de entre 5-11 años, siendo más frecuentes en niñas de raza blanca, ya que parece que el piojo tiene predilección por el pelo más cilíndrico de los individuos de esta raza (10). El contagio por p. capitis suele ser por contacto directo y es más frecuente en ambientes socieconómicos desfavorecidos. En el caso de los niños las condiciones sanitarias parecen influir menos que en adultos. Pueden afectar a cualquier clase o estrato social. Su aparición no significa necesariamente que se tengan malos hábitos higiénicos, de hecho el piojo prefiere cabellos limpios para vivir (16). Son posibles otras vías de contagio como a través de sombreros, contactos con tapicerías, ropa de cama, toallas, etc. (7). P. capitis tiene preferencia por el cuero cabelludo, sobre todo de la región occipital y retroauricular, aunque en ocasiones puede afectar otras zonas corporales (2,3). La afectación de las pestañas o cejas es excepcional (5).
P. corporis vive habitualmente en las ropas y sólo va a la piel para alimentarse. Las infestaciones por p. corporis son comunes en personas que viven en condiciones de pobreza y suciedad. En países civilizados está prácticamente restringida a vagabundos. Pueden trasmitir, actuando como vector, enfermedades como Tifus exantemático, fiebre de las trincheras y fiebre recurrente transmitida por piojos. P. pubis y p. capitis no han sido relacionados con la transmisión de enfermedades (17).
La infestación por p. pubis suele ser común en ambientes marginales. Es más frecuente en meses fríos (18). Debido a su escasa movilidad, la principal vía de contagio es por contacto directo o íntimo con una persona infestada. Hasta en un 30% de los casos podemos encontrar en estos pacientes otras enfermedades de transmisión sexual (19,20). Son también posibles los contagios por contactos con ropa infestada (toallas, sábanas, etc.) (17,21). P. pubis tiene predilección por zonas corporales pobladas por vello grueso como pubis, axilas, región perianal y en hombres también en barba, bigote y tronco, pudiendo afectar también a pestañas y cejas (22-24). La predilección por estas localizaciones viene en parte condicionada por su morfología. Al ser más ancho prefiere habitar en zonas con menor densidad de folículos pilosos (2). Excepcionalmente puede afectar al cuero cabelludo en adultos, aunque sí en niños (13,25). La autoinfestación de una región a otra es la causa más común de extensión de la parasitación (5,8,26). P. pubis es el más frecuentemente implicado en la pediculosis de las pestañas. En adultos esta localización es poco común (27), pero no así en niños donde se observa con cierta frecuencia al no existir otras zonas de vello grueso (28). El piojo prefiere el pelo de las pestañas al del cuero cabelludo, por disponer en esta localización de más espacio y menor temperatura (11,28). La presencia de p. pubis en los niños puede indicar existencia de abuso sexual (13,29), aunque puede existir un contagio directo no sexual por contacto con familiares o cuidadores infestados (10,28,30). Con todo ante un niño con una phthiriasis palpebral hemos de considerar la posibilidad de abuso sexual y es muy importante tratar el ambiente familiar para poder erradicar la infestación (13).
Además de factores sociosanitarios existen otras condiciones que pueden favorecer la infestación por piojos. Factores climáticos así como deficiencias en la dieta desempeñan un papel muy significativo. Dietas pobres en elementos esenciales como vitaminas, proteínas y minerales, aunque ricas en hidratos de carbono, disminuyen las resistencias del organismo favoreciendo las parasitaciones (31). Los déficits inmunitarios y tratamientos con corticoides e inmunosupresores favorecen las infestaciones (32-35), haciendo que se presenten formas atípicas y más graves de éstas (10). Se ha relacionado la susceptibilidad a infestaciones por piojos con los antígenos de histocompatibilidad (HLA). Las pediculosis por p. capitis son más frecuentes en individuos con HLA B5 y A11, y las phthiriasis son más frecuentes en individuos con HLA B5, A11 y B27 (36). Esta relación entre HLA y parasitaciones ha sido también encontrada con esquistosomiasis, filariasis, Giardiasis, leishmaniasis y sarna. El sistema HLA desarrolla un importante papel en el desarrollo de la respuesta inmune, de la tolerancia inmunológica y en la susceptibilidad a sufrir enfermedades. Distintos mecanismos genéticos, aún desconocidos podrían influenciar la patogénesis de las pediculosis y phthiriasis, pudiendo incrementar o disminuir la resistencia a la infestación, así como las mayores o menores complicaciones derivadas de ésta (36). En un trabajo nuestro, pendiente de publicación, describimos la mayor susceptibilidad de pacientes con Enfermedad de Crohn a sufrir infestaciones por P. pubis y discutimos sobre los distintos factores que en estos pacientes favorecen las parasitaciones (37-41).
CLÍNICA Y DIAGNÓSTICO
La Phthiriasis palpebral produce como síntoma principal una blefaritis pruriginosa asociada con una conjuntivitis folicular y frecuente linfadenopatía preauricular. Puede haber también una queratitis marginal y son frecuentes las sobreinfecciones bacterianas (2,5,42). El daño sobre los tejidos no es sólo producido por la picadura. La saliva, que el piojo deposita en la herida, y sus heces inducen una reacción de hipersensibilidad dérmica que produce un aumento de linfocitos tisulares, monocitos, macrófagos y fibroblastos (32,36). Esta reacción depende del grado de sensibilidad del paciente (6). La saliva del piojo contiene un fermento anticoagulante que favorece que éste permanezca sobre la misma picadura chupando sangre continuamente. Macroscópicamente en la zona de la picadura se observa una lesión azulada (mácula cerúlea) que es el resultado de la acción del fermento salival sobre la sangre y de la respuesta inflamatoria hística local. Ante una phthiriasis palpebral hemos de investigar la más que probable existencia de piojos en otras localizaciones. En todas ellas el prurito, lesiones por rascado, máculas cerúleas y restos fecales del piojo son importantes en el diagnóstico.
Más rara es la afectación ocular por p. capitis ya que tiene poca predilección por esta localización, pero dada su movilidad los hemos visto en las cejas y pestañas de personas con pediculosis del cuero cabelludo (fig. 6). P. capitis puede producir conjuntivitis hasta en un 10% de los pacientes con pediculosis del cuero cabelludo (36). En cuero cabelludo son típicas las lesiones y escoriaciones producidas por el rascado, así como la presencia de linfadenopatía y reacciones locales a la mordedura. El prurito es el síntomas más frecuente. Rara vez p. corporis afecta al ojo. En los vagabundos produce una infiltración cutánea con hiperpigmentación denominada melanodermia de los vagabundos (4).

Fig. 6. Ejemplar adulto de pediculus capitis localizado en una ceja.
El diagnóstico de phthiriasis palpebral es fácil si observamos los piojos en las pestañas o cejas (figs. 7 y 8). P. pubis puede pasar fácilmente desapercibido. Es transparente y se ancla a la epidermis permaneciendo inmóvil y agazapado (fig. 9). La presencia de restos fecales o sangre en su tubo digestivo puede sernos de gran utilidad en el diagnóstico (fig. 10) (42,43), así como la presencia de máculas cerúleas en el borde palpebral (8,17). Cuando tratamos de extraer el piojo, éste permanece fuertemente adherido a la pestaña, siendo necesario en ocasiones arrancar la pestaña para poder eliminarlo (figs. 11 y 12) (37). La presencia de liendres es también diagnóstica de phthiriasis palpebral (fig. 13). P. capitis es más difícil de observar en las pestañas o cejas ya que no tiene predilección por esta localización. Es transparente y más móvil que p. pubis.


Fig. 7 y 8. Ejemplares adultos de Phthirus pubis localizados en las pestañas.

Fig. 9. Ejemplar adulto de Phthirus pubis. El parásito está agazapado entre las
pestañas y su observación puede pasarnos fácilmente desapercibida.

Fig. 10. Ejemplar adulto de Phthirus pubis. La presencia de restos hemáticos en el tubo
digestivo del parásito puede facilitarnos su diagnóstico.
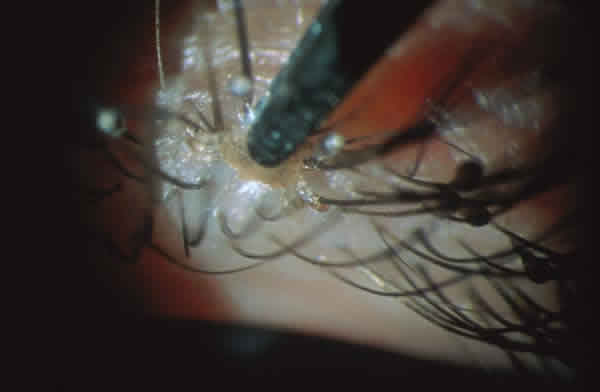

Fig. 11 y 12. Ejemplar adulto de Phthirus pubis. El parásito permanece fuertemente
adherido a las pestañas con sus garras. En ocasiones es preciso arrancar las pestañas
para poder extraerlo.

Fig. 13. Liendres de Phthirus pubis. Se aprecian abundantes liendres depositadas en
la base de las pestañas. Su presencia es también diagnóstica de Phthiriasis palpebral.
TRATAMIENTO
Muchos agentes terapéuticos, sobre todo insecticidas, han sido utilizados en el tratamiento de las pediculosis. Existen estudios randomizados comparando la eficacia pediculicida y ovicida, tanto in vitro como en vivo, de distintos agentes (43). Un buen insecticida es aquel que es eficaz tanto para adultos como para las liendres y una sola aplicación suele ser efectiva para erradicar la infestación. La eficacia de un pediculicida depende de su potencia, dosificación, modo de empleo, efectos secundarios y posibles resistencias (9,10). La potencia se mide como porcentaje de destrucción tanto de adultos como de liendres in vitro. Por lo general a mayor dosis más potencia pediculicida, pero también más efectos tóxicos. Las formulaciones en vehículos alcohólicos suelen ser más eficaces que las acuosas pero más tóxicas (11). Los pediculicidas se pueden aplicar en forma de loción, cremas, aerosol, champú, oral, polvos, etc. La loción aporta altas concentraciones en una sola aplicación. Aerosoles, cremas y champús tienen un menor tiempo de contacto aportando menos dosificación lo que favorece las resistencias (10,44). Se han descrito resistencias en mayor o menor grado frente a casi todos los pediculicidas (45). En el tratamiento de las pediculosis han sido utilizados:
Hexacloruro de gammabenceno o lindano. Es un insecticida organoclorado eficaz como pediculicida y ovicida. Actúan sobre el sistema nervioso central y periférico provocando una parálisis neuromuscular. Una sola aplicación suele ser suficiente para erradicar el piojo, aunque es aconsejable repetirla a los 7 días. Se presenta al 1% en loción, champú y crema (Kife®) y al 0,3% (Yacutin®). La loción se deja actuar entre 12-24 horas lavándose después. Su utilización cerca del ojo no es recomendable por su toxicidad (2,28), aunque algunos autores lo han empleado con eficacia en el tratamiento de la phthiriasis palpebral (28). Es un agente liposoluble. Un 10% del producto se absorbe a través de la piel siendo eliminado por orina (46,47). Esta absorción es mayor en niños. Se han descrito casos de neurotoxicidad, sobre todo en niños, en forma de crisis epilépticas, vértigos, irritabilidad, nerviosismo, insomnio, estupor y coma (2,5,9). También casos de arritmia y anemia aplásica (47). En la actualidad el lindano es poco utilizado como pediculicida debido a la gran cantidad de resistencias y a su toxicidad (10,48).
Clorofenotano (DDT). Es también un insecticida organoclorado (49) que se ha empleado en concentraciones de 2 y 5% en loción para el tratamiento de las pediculosis. También lo hay en polvos al 10% para el tratamiento de las ropas (46). No ha sido empleado en tratamientos oculares. Al igual que el lindano es poco utilizado en la actualidad como pediculicida por la existencia de numerosas resistencias.
Agentes anticolinesterasa. Actúan inhibiendo la función de la acetilcolinesterasa, enzima que bloquea la acción de la acetilcolina en las terminaciones nerviosas colinérgicas centrales y periféricas. Existen dos grandes grupos según su acción sea o no reversible (50). De los reversibles el más utilizado en el tratamiento de las pediculosis ha sido la fisostigmina, o eserina, en pomada al 0,25% (2). Es una amina terciaria que inhíbe la transmisión nerviosa del piojo produciéndole ataxia y postración. No es efectivo contra las liendres (46). Su uso está poco extendido porque el producto no está comercializado. El Carbaril es un insecticida muy utilizado en agricultura. Actúa como la fisiostigmina. Penetra poco a través de la piel y es poco tóxico, aunque potencialmente cancerígeno (10,50). Los agentes anticolinesterasa irreversibles están representados por los organofosforados. Los más utilizados en el tratamiento de las pediculosis han sido el parathion y sobre todo el malathion. El malathion (Prioderm®, Filvit®) ha demostrado ser muy eficaz tanto frente a piojos como liendres en una sola aplicación. Se ha utilizado en champú acuoso al 1% aplicado cuidadosamente sobre el margen palpebral con algodón durante cinco minutos, repitiendo la aplicación 10 días después. Está también disponible en loción al 0,5% en vehículo de alcohol isopropilo (48). Éste es más eficaz que el champú pero no aplicable en tratamientos oculares. El malathion se metaboliza rápidamente en mamíferos mediante hidrólisis por una enzima hepática llamada carboxilesterasa. En insectos esta metabolización es mucho más lenta por lo que existe una mayor toxicidad selectiva en ellos (47,48). Se absorbe un 10% a través de la piel, si bien a dosis habituales es poco probable la aparición de toxicidad neurológica (9,50). Aunque se han descrito resistencias (10,48), el malathion es uno de los insecticidas más eficaces (44,51). En 10 minutos de exposición mata al 100% de los piojos y al 95% de las liendres (10). No debe utilizarse en menores de 6 años.
Piretrinas y derivados. La piretrina es un extracto de la flor del piretro, perteneciente a la familia de los crisantemos (13,49). Los piretroides son derivados sintéticos de la piretrina. Destacamos la tetrametrina (Neopynamin®), fenotrina (Itax®, Sumitrin®, Antipiox®, Cusitrin®, Mitigal®) y aletrina (Vapio®). Son insecticidas de contacto que actúan sobre el sistema nervioso produciendo sobre el insecto una intensa agitación seguida de una parálisis general. Se emplean mucho como insecticidas domésticos por su baja toxicidad ya que son bastante inocuos. En general tienen poco efecto sobre liendres (48). En mamíferos se hidrolizan rápidamente. En los insectos esta hidrólisis es más lenta favoreciendo en ellos una mayor toxicidad selectiva. Esta toxicidad se incrementa con la adicción del butóxido de piperonilo que al inhibir la citocromo P 450, disminuye aún más la hidrólisis de las piretrinas en los insectos aumentando su actividad como insecticida (49). Algunos piretroides como la fenotrina son eficaces pediculicidas y ovicidas (44,51). Existen preparados en forma de loción, champú y gel en donde se suele combinar una piretrina o derivado piretroide con butóxido de piperonilo en un vehículo destilado de petrolatum. El producto se deja actuar durante 10 minutos y luego se lava. Las piretrinas son importantes alergenos, habiéndose detectado casos de dermatitis de contacto y alergias respiratorias (49). Se ha comunicado la muerte de un niño asmático por utilización de piretrinas en aerosol (10). Estas reacciones adversas son menos importantes con los piretroides. En general no es recomendable la utilización de las piretrinas en el tratamiento de la phthiriasis palpebral por su toxicidad ocular (25).
Permetrina. La pomada de permetrina al 5% (Busvine®) se ha empleado como tratamiento de la phthiriasis palpebral. Es menos tóxico que las piretrinas y otros insecticidas para tratamientos tópicos cerca del ojo (17). La permetrina pertenece a los piretroides sintéticos denominados de segunda generación (52). En comparación con los piretroides naturales y sentéticos presenta una mayor actividad insecticida, un efecto residual prolongado, baja toxicidad y no se degrada en contacto con el agua. Se absorbe rápidamente por la cutícula del insecto y actúa sobre las membranas celulares de las células nerviosas provocando alteraciones electroquímicas que retrasan la repolarización celular y subsiguiente parálisis y muerte del piojo. La permetrina se detecta en cabellos en cantidades residuales durante al menos 10 días después de un tratamiento. Tiene efecto repelente y al contrario que otros piretroides es bastante activo contra las liendres. La utilización simultánea de trimetropinsulfametoxazol oral aumenta su actividad insecticida (9). También se ha empleado como escabicida (10). Hay preparados en forma de loción, crema, champú y solución alcohólica al 1,5% (Piretrina 1,5 OTCR) y al 1% (Nix®, Kife P® y Quellada®). Existe también la preparación en polvos para el tratamiento de las ropas. A pesar de ser un piretroide no se suele asociar al butóxido de piperonilo (6). Aunque es un buen pediculicida, se han descrito resistencias (53).
Ivermectina. La ivermectina (Estromectol®) es un agente antihelmíntico que ha sido probado como parasiticida en veterinaria desde 1981 y aprobado por la Food and Drug Administration para el uso en humanos en tratamientos de oncocercosis, estrongiloidosis, loasis, filariasis, lava migrans, sarna y pediculosis (11). La ivermectina actúa por bloqueo químico en las transmisiones sinápticas que utilizan glutamato o GABA como neurotrasmisor. La toxicidad de este producto es selectiva para insectos, ya que en humanos no existen transmisiones sinápticas que utilicen estos mediadores. En el tratamiento de las pediculosis y phthiriasis, se puede utilizar por vía oral (11) o en forma de champú o loción (10,54). Una sola dosis de 200 microgramos/kg de peso repetida 7 días después suele ser suficiente para erradicar el piojo (11). La vida media de la ivermectina oral es de 16 horas. Es sólo activa frente a adultos y larvas que son los que se alimentan de la sangre, no teniendo acción ovicida. Se ha de emplear con cuidado en niños inferiores a 15 kg de peso y en embarazadas, así como en pacientes ancianos. Aunque se ha descrito un caso de muerte en una anciano relacionado con ivermectina (55), el tratamiento con este producto es muy seguro.
Óxido amarillo de mercurio. Ampliamente utilizado en el tratamiento de la phthiriasis palpebral (2,5). Se presenta en pomada al 1% que se aplica sobre el párpado unos minutos, dos veces al día y luego se lava. No tiene efecto ovicida por lo que se ha de mantener al menos durante 14 días. Presenta efectos adversos sobre párpados, en forma de irritación, conjuntivitis, descemetitis, decoloración del cristalino, fotofobia, visión borrosa, quemazón y epífora. En general es bastante eficaz habiéndose empleado con seguridad en niños.
Fluoresceína. Al 20% ha sido utiliza como pediculicida en el tratamiento de la phthiriasis palpebral. No tiene actividad ovicida y es bastante tóxico para el ojo (17).
Petrolatum. Es una base de emulsión hidromiscible que se aplica sobre el margen palpebral dos veces al día durante al menos 8 días. No tiene actividad contra las liendres y es bastante tóxico para el ojo.
Queroseno. Es un hidrocarburo alifático que se puede aplica sobre el margen palpebral.
El benzoato de bencilo, la pomada de azufre, el Crotamitrón (Eurax®) y el Oleato cúprico (Cuprex®) son conocidos escabicidas que en ocasiones se han empleado también como pediculicidas (10,47). No se ha utilizado en el tratamiento de la phthiriasis palpebral. Otros insecticidas como imida, cloprid, fipronil y monoterpenos han sido utilizados como pediculicidas (10).
Crioterapia. La aplicación de frío sobre el piojo produce una muerte rápida de éste y no genera molestias. En niños es difícil de aplicar. En general no es un tratamiento de primera elección (2,5).
Fototerapia con Argon láser. Es también un método eficaz y rápido para destruir tanto al piojo como a las liendres. Como incoveniente puede dañar las pestañas, aunque de forma reversible, y sólo se puede utilizar en pacientes colaboradores (5,56).
Ante un paciente con phthiriasis palpebral hemos de investigar la más que probable afectación sistémica. El tratamiento por tanto no sólo debe ir encaminado a eliminar el piojo de las pestañas, sino que debemos realizar también un tratamiento global tanto del paciente como de sus ropas, objetos personales y su entorno. Hemos de investigar y tratar otras enfermedades de transmisión sexual que frecuentemente asocian, así como estudiar a los familiares y contactos sexuales de los pacientes. El tratamiento de la pediculosis palpebral presenta dificultades añadidas por la alta toxicidad de estos compuestos sobre el epitelio corneal y conjuntival. Existen preparaciones tópicas de distintos agentes, normalmente en vehículos acuosos, que aunque menos tóxicos también son poco eficaces. El tratamiento más efectivo de la Phthiriasis palpebral es la eliminación mecánica de los ejemplares adultos y de las liendres, bajo exploración con lámpara de hendidura (2,5,8). En niños esta práctica suele ser difícil teniendo que recurrir a sedación. En tratamientos oculares, la pomada de óxido amarillo de mercurio y de permetrina son bastante eficaces y no muy tóxicos si se emplean adecuadamente. Para el tratamiento de otras localizaciones malathion, permetrina, piretrinas e ivermectina han demostrado ser los más eficaces, ya que son poco tóxicos y por ahora son los que menos resistencias tienen. En casos de resistencia es recomendable cambiar a otro agente o añadir uno nuevo (10,44), aunque también se han comunicado resistencias dobles al malathion y piretrinas (57). Algunos preparados como el Paraplus® asocian varios insecticidas (6).













 Puede parecer una lucha perdida, pero eso no significa que no haya que seguir dando batalla a esas diminutas alimañas que pueblan las cabezas de seis de cada diez chicos argentinos. Es que como reconoce la Academia Americana de Pediatría, de los Estados Unidos, que acaba de publicar en la revista Pediatrics un extenso informe sobre el tema, "probablemente sea imposible prevenir todos los contagios de piojos".
Puede parecer una lucha perdida, pero eso no significa que no haya que seguir dando batalla a esas diminutas alimañas que pueblan las cabezas de seis de cada diez chicos argentinos. Es que como reconoce la Academia Americana de Pediatría, de los Estados Unidos, que acaba de publicar en la revista Pediatrics un extenso informe sobre el tema, "probablemente sea imposible prevenir todos los contagios de piojos".